-
하이 라이트
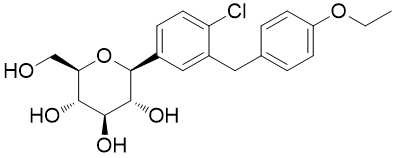
461432-26-8 제약 중간체
,C21H25ClO6 제약 중간체
,제약 Dapagliflozin 중간체
-
상품 이름다파글리프로진
-
동의어다파글리프로진 ;(1S)-1,5-Anhydro-1-C-[4-chloro-3-[(4-ethoxyphenyl)methyl]phenyl]-D-glucitol ;다파글리프로진 프로판디올
-
CAS461432-26-8
-
MfC21H25ClO6
-
MW408.88
-
EINECS639-683-0
-
비등점609.0±55.0 'C(Predicted)
-
비중1.349
-
순도99%
-
원래 장소중국
-
브랜드 이름RUN
-
인증IOS9001
-
모델 번호RUN-Z
-
최소 주문 수량10g
-
가격inquiry
-
포장 세부 사항10g 50g 100g 500g 1 킬로그램
-
배달 시간3-7 일
-
지불 조건전신환, 머니그램, 브트크코인
-
공급 능력1 킬로그램 --100 킬로그램
461432-26-8 다파글리플로진 S1548 셀렉 C21H25ClO6 639-683-0
섹션 1: 기본 정보
| 다파글리플로진 기본정보 |
| 당뇨병 치료제 약리학적 효과 약동학 합성 방법 안전 약물 상호 작용 |
| 상품명: | 다파글리플로진 |
| 동의어: | 다파글리플로진;(1S)-1,5-무수-1-C-[4-클로로-3-[(4-에톡시페닐)메틸]페닐]-D-글루시톨;다파글리플로진 프로판디올;BMS-512148-05;다파글리플로진 S1548 셀렉;다파글리플로진 베이스;달리칸;다파글리플로지 |
| CAS: | 461432-26-8 |
| MF: | C21H25ClO6 |
| MW: | 408.88 |
| 아이넥스: | 639-683-0 |
| 제품 카테고리: | 억제제;기타 API;아피스;방향족;헤테로사이클;중간체 및 정밀화학;의약품 |
| 몰 파일: | 461432-26-8.mol |
| 다파글리플로진 속성 |
| 비점 | 609.0±55.0 °C(예상) |
| 밀도 | 1.349 |
| pka | 13.23±0.70(예상) |
| 안전 정보 |
| 다파글리플로진 사용법 및 합성 |
| 당뇨병 치료제 | Dapagliflozin(ForxigaTM)은 Bristol-Myers Squibb와 AstraZeneca가 공동 개발한 새로운 당뇨병 치료제로 2012년 11월 12일 EMA(European Medicines Agency)의 승인을 받았습니다. 또한 제2형 당뇨병 치료제로 승인된 최초의 SGLT2 억제제이기도 합니다. , 당뇨병 치료에 있어 중요한 선택사항이며 제2형 당뇨병이 있는 성인을 위한 식이 및 운동의 부속물로 혈당 조절을 개선하는 데 사용됩니다. 다파글리플로진은 나트륨-포도당 공동수송체 2 억제제입니다.2014년 1월 8일, 미국 식품의약국(FDA)은 제2형 당뇨병 치료에 사용하도록 승인했습니다.한편, FDA는 생산자에게 약물 관련 위험에 대한 시판 후 연구를 수행할 것을 요구합니다. FDA가 요청한 시판 후 시험에는 베이스라인에서 다파글리플로진 치료 후 고위험 환자의 심혈관 위험을 평가하기 위한 심혈관 결과 시험과 모집된 환자에서 방광암 위험을 평가하기 위한 연구가 포함된다.또 다른 연구는 설치류 동물에 대한 이 약물의 방광 종양 촉진 효과를 평가할 것입니다.2건의 연구가 소아 환자에서 다파글리플로진의 약동학, 효능 및 안전성을 평가할 것입니다.강화된 약물감시 프로그램 세트는 다글리타존을 투여받는 환자의 간 이상 및 임신 결과 보고서를 모니터링합니다.Dapagliflozin은 Haoeyou Pharmacy에서 Farxiga라는 상표명으로 판매될 예정입니다. 위 정보는 케미컬북의 Andy가 편집한 것입니다. |
| 약리학적 효과 | 다파글리플로진은 포도당을 혈류로 재흡수하는 신장의 단백질인 SGLT2(나트륨-포도당 수송체 2)를 억제함으로써 작용합니다.이것은 여분의 포도당이 소변을 통해 배설되도록 하여 인슐린 분비를 증가시키지 않으면서 혈당 조절을 향상시킵니다.이 약을 사용하려면 신기능이 정상인 환자가 필요하며 중등도에서 중증의 신부전 환자는 이 약을 사용할 수 없습니다.이 제품의 단일 적용 또는 메트포르민, 피오글리타존, 글리메피리드, 인슐린 및 기타 약물과의 조합은 제2형 당뇨병을 앓고 있는 환자의 HbA1c 및 공복 혈당을 상당히 감소시킬 수 있습니다.이상반응의 빈도는 저혈당 위험이 낮은 위약과 유사하여 체중을 줄일 수 있었습니다. 다파글리플로진의 효능은 디펩티딜 펩티다제 억제제 및 여러 가지 새로운 혈당강하제와 비슷하며 혈압과 체중을 약간 낮출 수 있습니다.이 약은 5mg과 10mg 2개의 정제를 선택할 수 있으며 단독으로 또는 다른 당뇨병 약물을 포함한 인슐린과 함께 사용할 수 있습니다. |
| 약동학 | 건강한 피험자에서 다파글리플로진은 경구 투여 후 빠르게 흡수되었으며 피크 시간 Tmax는 1~2시간, 단백질 결합률은 91%, 경구 생체 이용률은 약 78%, 혈장 말단 반감기는 12.9시간이었습니다.경구 투여 후, 이 약물은 주로 우리딘 이인산 글루쿠로노실트랜스퍼라제 1A9(UGT1A9)에 의해 간에서 비활성 대사물로 대사되며 더 작은 부분은 P450 효소에 의해 대사되고 P450 효소에 대한 억제 또는 유도 효과가 없습니다.약물 원형 및 관련 대사산물은 소변(75%)과 대변(21%)을 통해 배설되었습니다.이 제품을 고지방 식품과 동시 투여, 공복 투여와 비교하면 Tmax는 1배 연장될 수 있지만 흡수는 정도에 영향을 미치지 않으므로 음식과 함께 투여할 수 있다. daglitazone의 약동학은 신기능에 의해 유의한 영향을 받았다.경증, 중등도 또는 중증의 신부전증이 있는 당뇨병 환자는 병합하여 7일 동안 20 mg • d-1 daglitazone을 경구 투여합니다.평균 전신 노출량은 정상 신기능 환자와 비교하여 각각 32%, 60% 및 87% 더 높습니다.신기능이 정상인 환자의 경증, 중등도, 중증의 신기능 부전 환자에서 정상 상태의 24시간 동안의 요당 배설량은 85, 52, 18, 11g이었다. Kasichayanula 등은 daglitazone에 대한 간 기능 장애의 약동학 효과를 연구했습니다.daglitazone 10mg을 1회 경구 투여한 경증, 중등도 및 중증 간부전 환자는 정상 간 기능을 가진 환자보다 각 그룹의 Cmax가 각각 12%, 12%, 40% 높았다.각 그룹의 AUC는 정상 간 기능보다 3%, 36%, 67% 유의하게 높았다. 따라서 중등도 및 중증의 신기능 장애 환자에게 daglitazone을 사용하는 것은 권장되지 않습니다.중증 간기능 장애 환자는 용량을 줄여야 합니다. |
| 합성 방법 | 5-브로모-2-클로로벤조산은 염소화 아실화 반응을 일으키고 프리델-크래프트 반응을 페닐에틸에테르와 반응시켜 카르보닐기를 환원시켜 5-브로모-2-클로로-4'-에톡시디페닐메탄을 생성하고 추가로 축합한다. 2,3,4,6-테트라-O-트리메틸실릴-D-글루코피라노산-1,5-락톤.아노머 탄소 수산기는 에테르화 및 탈보호되어 2-클로로-5-(1-메톡시-D-글루코피라노스-1-일)-4'-에톡시디페닐메탄을 생성한 다음 Et3SiH/BF3 • OEt2를 사용하여 환원시켜 제거한다. 메톡시, 그 다음 아세트산 무수물 에스테르화 및 가수분해를 통해 약 40%의 전체 수율로 혈당 강하제인 다글리타존을 제공합니다. 도 1은 다파글리플로진 합성의 화학 반응 경로를 나타낸다. |
| 안전 | Daglitazone은 10mg • d-1 daglitazone과 관련된 이상반응 발생률이 위약과 유사하여 내약성과 안전성이 우수합니다.일반적인 부작용으로는 저혈당, 다뇨, 요통, 생식기 감염, 요로 감염, 이상지질혈증 및 적혈구용적률(HCT) 증가가 있습니다.저혈당의 전반적인 위험은 낮고 저혈당의 발생률은 다른 기본 혈당강하제와 관련이 있습니다.저혈당 발생률은 위약에 비해 다글리타존과 설포닐우레아 또는 인슐린을 병용 투여한 환자에서 더 높았다.따라서 이 약을 인슐린 또는 인슐린 분비촉진제와 병용할 경우 후자의 용량을 조절해야 할 수 있습니다. |
| 약물 상호 작용 | 이 제품은 주로 P-당단백질 기질인 UGT1A9 대사에 의해 간에서 대사됩니다.연구에 따르면 다글리타존의 약동학은 메트포르민, 피오글리타존, 시타글립틴, 글리메피리드, 보글리보스, 심바스타틴, 발사르탄, 와파린 및 디곡신에 의해 영향을 받지 않는 것으로 확인되었습니다.위에서 언급한 약물의 혈청 농도 또한 daglitazone에 의해 임상적으로 유의한 영향을 받지 않습니다.Rifampicin은 daglitazone의 노출량을 22% 감소시킬 수 있는 반면 mefenamic acid는 신체 노출량을 51% 증가시킬 수 있지만 24시간 소변 포도당 배설에 임상적으로 유의한 영향은 없습니다. |
| 설명 | 호주 의약품청(TGA)과 유럽 위원회는 2012년 10월과 11월에 다파글리플로진을 제2형 당뇨병 치료를 위한 식단과 운동의 보조제로 각각 승인했습니다.Dapagliflozin은 포도당 민감성 및 인슐린 비의존적 작용 기전으로 인해 잠재적으로 매력적인 치료법입니다.동급 최초의 선택적 SGLT2 억제제(IC50=1.1nM;선택성 대 SGLT1 >1000) 포도당 재흡수에 대한 신장 역치를 낮추어 과도한 포도당이 신장을 통해 제거되도록 합니다.정상 쥐에서 다파글리플로진의 투여는 24시간 동안 최대 1900mg의 포도당의 용량 의존적 배설을 촉진하고 최대 효과는 3mg/kg입니다.당뇨병의 쥐 모델에서 췌장 독소 스트렙토조토신으로의 전처리는 비히클과 비교하여 다파글리플로진의 단일 0.1 mg/kg 용량 투여에 의해 55% 감소된 고혈당을 초래합니다.아릴 O-글루코시드 SGLT2 억제제는 초기에 임상에 진입했지만 다파글리플로진에서 발견된 아릴 C-글루코시드 결합은 글루코시다제 매개 대사에 대한 내성을 부여하여 아릴 O-글루코시드에 비해 임상적 유용성을 개선했습니다.변형된 탄수화물-아글리콘 연결은 강력한 SGLT2 억제를 달성하기 위해 오르토-에서 메타-치환된 아릴글루코시드로의 동시 조정이 필요했습니다.Dapagliflozin은 아릴리튬과 per-silylated gluconolactone의 반응을 통해 여러 단계로 합성되어 핵심 C-글루코시드 결합을 형성했습니다.생성된 아노머 글리코시드의 알파-선택적 환원은 원하는 베타-카릴글루코시드를 제공하였다.주요 순환(비활성) 대사 산물은 글루코실 부분의 3-O-글루쿠론산화의 결과입니다.소수의 대사 산물 중에서 주요 산화 종은 ethoxy-group의 O-dealkylation과 biarylmethane moiety의 수산화로 인해 발생합니다. |
| 화학적 특성 | 백색 고체 |
| 창작자 | Bristol-Myers Squibb(미국) |
| 용도 | 나트륨-포도당 수송체 2 억제제. |
| 용도 | 당뇨병 I 또는 II 및 고혈당 치료제 |
| 정의 | ChEBI: 아노머 하이드록시 그룹이 4-클로로-3-(4-에톡시벤질)페닐 그룹으로 대체된 베타-D-글루코스를 포함하는 C-글리코실.제2형 당뇨병이 있는 성인의 식이 및 운동과 함께 혈당 조절을 개선하기 위해 (프로판디올 일수화물 형태로) 사용됩니다. |
| 상표명 | 포시가 |